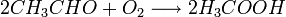viernes, 10 de junio de 2011
PROCEDIMIENTO PARA LA OBTENCION DE ACIDO ACETICO
EL OBJETO DE LA INVENCION ES UN PROCEDIMIENTO PARA LA OBTENCION DE ACIDO ACETICO MEDIANTE OXIDACION EN FASE GASEOSA DE HIDROCARBUROS SATURADOS C4 Y SUS MEZCLAS CON HIDROCARBUROS INSATURADOS DE C4 EN UN REACTOR TUBULAR UTILIZANDO UN CATALIZADOR DE CUBIERTA, QUE SE COMPONE DE UN CUERPO SOPORTE SIN POROS E INERTE Y UNA MASA COMPUESTA DE OXIDOS CATALITICAMENTE ACTIVA COLOCADA SOBRE LA CAPA EXTERIOR DEL CUERPO SOPORTE, QUE CONTIENE A) UNO O VARIOS OXIDOS DEL GRUPO DEL DIOXIDO DE TITANIO, DIOXIDO DE ZIRCONIO, DIOXIDO DE ESTAÑO, OXIDO DE ALUMINIO, Y B) 0, 1 HASTA 1, 5 % EN PESO, CON RELACION AL PESO DEL COMPONENTE A) Y POR M 2 /G DE SUPERFICIE ESPECIFICA DEL COMPONENTE A), PENTOXIDO DE VANADIO, HACIENDO REACCIONAR UNA MEZCLA GASEOSA, QUE CONTIENE OXIGENO O GAS QUE LLEVA OXIGENO, UNO O VARIOS HIDROCARBUROS DE C 4 Y VAPOR DE AGUA, UNA RELACION DE LA MEZCLA EN VOLUMENES DEL HIDROCARBURO DE C 4 /AIRE (OXIGENO) DE 0, 2/99, 8 HASTA 25/75 Y LA RELACION DE LA MEZCLA EN VOLUMEN DEL HIDROCARBURO DE C 4 /VAPOR DE AGUA DE 1/1 HASTA 1/60, A UNA TEMPERATURA DE 100 C HASTA 400 C Y UNA SOBREPRESION DE 0, 2 HASTA 50 BARES EN EL CATALIZADOR DE CUBIERTA.
procedimiento para la obtencion de acido acetico mediante oxidacion en fase gaseosa en hidrocarburos saturados de c4 y sus mezclas con hidrocarburos insaturados de c4 (Equipo)
EBERLE, HANS-JURGEN, DR.
procedimiento para la obtencion de acido acetico mediante oxidacion en fase gaseosa en hidrocarburos saturados de c4 y sus mezclas con hidrocarburos insaturados de c4 (Responsables)
Ácido acético
El ácido acético,ácido metilencarboxílico o ácido etanoico, se puede encontrar en forma de ion acetato. Éste es unácido que se encuentra en el vinagre, siendo el principal responsable de su sabor y olor agrios. Su fórmula es CH3-COOH (C2H4O2). De acuerdo con la IUPAC se denomina sistemáticamente ácido etanoico.
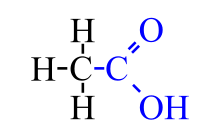
Fórmula química; el grupo carboxilo, que le confiere la acidez, está en azul
Es el segundo de los ácidos carboxílicos, después del ácido fórmico o metanoico, que sólo tiene un carbono, y antes del ácido propanoico, que ya tiene una cadena de tres carbonos.
El punto de fusión es 16,6 °C y el punto de ebullición es 117,9 °C.
En disolución acuosa, el ácido acético puede perder el protón del grupo carboxilopara dar su base conjugada, el acetato. Su pKa es de 4,8 a 25 °C, lo cual significa, que al pH moderadamente ácido de 4,8, la mitad de sus moléculas se habrán desprendido del protón. Esto hace que sea un ácido débil y que, en concentraciones adecuadas, pueda formar disoluciones tampón con su base conjugada. La constante de disociación a 20 °C es Ka = 1,75·10-5.
Es de interés para la química orgánica como reactivo, para la química inorgánica como ligando, y para la bioquímica comometabolito (activado como acetil-coenzima A). También es utilizado como sustrato, en su forma activada, en reaccionescatalizadas por las enzimas conocidas como acetiltransferasas, y en concreto histona acetiltransferasas.
Hoy en día, la vía natural de obtención de ácido acético es a través de la carbonilación (reacción con CO) de metanol. Antaño se producía por oxidación de etileno en acetaldehído y posterior oxidación de éste a ácido acético.
Oxidación del acetaldehído
Previo a la comercialización del proceso Monsanto, la mayor parte de ácido acético era producido por oxidación del acetaldehído. Este permanece como el segundo método más importante de fabricación, aunque no es competitivo con la carbonilación del metanol.
El acetaldehído puede ser producido por oxidación del butano o nafta ligera, o por hidratación del etileno. Cuando el butano o la nafta ligera son calentados con aire en la presencia de varios iones metálicos, incluyendo los de manganeso, cobalto y cromo; se forma el peróxido y luego se descompone para producir ácido acético según la ecuación química:
Generalmente, la reacción se lleva a cabo en una combinación de temperatura y presión diseñadas para ser lo más caliente posibles mientras se mantiene al butano en fase líquida. Unas condiciones de reacción típicas son 150 °C and 55 atm. Se pueden formar subproductos, que incluyen a la butanona, acetato de etilo, ácido fórmico, y ácido propiónico. Estos subproductos también son de valor comercial, y las condiciones de reacción pueden ser modificadas para producir más de ellos si son económicamente útiles. Sin embargo, la separación de ácido acético de los subproductos agrega costo al proceso.
Bajo condiciones similares, y usando catalizadores similares a los usados para la oxidación del butano, el acetaldehído puede ser oxidado por el oxígeno en el aire para producir ácido acético
Usando catalizadores modernos, esta reacción puede tener un rendimiento de ácido acético superior al 95%. Los principales subproductos son el acetato de etilo, ácido fórmico yformaldehído, todos ellos con un punto de ebullición menor que el del ácido acético, y se pueden separar fácilmente por destilación.7
[editar]Oxidación del etileno
El acetaldehído puede ser preparado a partir del etileno por medio del proceso Wacker, y luego ser oxidado como se describió anteriormente. Más recientemente se ha comercializado una conversión del etileno a ácido acético más barata y en una sola etapa por la compañía química Showa Denko, que abrió una planta de oxidación de etileno en Ōita, Japón, en 1997.8El proceso está catalizado por un catalizador metálico de paladio en un soporte de heteropoliácido, tal como el ácido tungstosilícico. Se cree que este método es competitivo con la carbonilación del metanol en plantas pequeñas (100–250 kt/a), dependiendo del precio local del etileno.
[editar]Fermentación oxidativa
Durante la mayor parte de la historia de la humanidad, el ácido acético, en la forma de vinagre, ha sido preparado por bacterias del género Acetobacter. En presencia de suficiente oxígeno, estas bacterias pueden producir vinagre a partir de una amplia variedad de alimentos alcohólicos. Algunos insumos comunes son la sidra, el vino, cereal fermentado, malta,arroz, o patatas. La reacción química general facilitada por estas bacterias es:
Una solución diluida de alcohol, inoculada con Acetobacter y mantenida en un lugar cálido y aireado se hará vinagre en el transcurso de algunos meses. Los métodos industriales de preparación de vinagre aceleran este proceso al mejorar el suministro de oxígeno a las bacterias.
Probablemente, la primera producción vinagre fue consecuencia de errores en la fermentación durante el proceso de elaboración de vino. Si el mosto se fermenta a temperatura demasiado alta, acetobacter dominará a la levadura presente naturalmente en las uvas. Al aumentar la demanda de vinagre para fines culinarios, médicos y sanitarios,, los productores de vinos aprendieron rápidamente a usar otros materiales orgánicos para producir vinagre en los meses cálidos de verano, antes que las uvas maduren y estén listas para ser procesadas en vino. Sin embargo, este método era lento y no siempre exitoso, y los productores de vino no entendían el proceso.
Uno de los primeros procesos comerciales modernos era el "método rápido" o "método alemán", practicado primero en Alemania en 1823. En este proceso, la fermentación tiene lugar en una torre empacada con virutas de madera o carbón. El insumo alcohólico es bombeado en la parte superior de la torre y aire fresco es suministrado desde la base, por convecciónnatural o forzada. El suministro de aire mejorado en este proceso reduce el tiempo para preparar vinagre de meses a semanas.
La mayor parte del vinagre hoy en día es hecho en cultivo de tanque sumergido, descrito por primera vez en 1949 por Otto Hromatka y Heinrich Ebner. En este método, el alcohol se fermenta a vinagre en un tanque agitado continuamente, y se suministra oxígeno burbujeando aire a través de la solución. Usando aplicaciones modernas de este método, se puede preparr vinagre de 15% ácido acético en sólo 24 horas en un proceso.
Fuente:
Acetona
La acetona o propanona es un compuesto químico de fórmula química CH3(CO)CH3 del grupo de las cetonas que se encuentra naturalmente en el medio ambiente. A temperatura ambiente se presenta como un líquido incoloro de olor característico. Se evapora fácilmente, es inflamable y es soluble en agua. La acetona sintetizada se usa en la fabricación deplásticos, fibras, medicamentos y otros productos químicos, así como disolvente de otras sustancias químicas.
Nomenclatura
La nomenclatura de la acetona según la IUPAC es propanona. Y la nomenclatura común es dimetil cetona. Son erróneas por redundantes las denominaciones 2-propanona y propan-2-ona porque el grupo funcional cetona sólo puede encontrarse en el segundo carbono de la molécula.
[editar]Solubilidad
Este compuesto es miscible en agua.
[editar]Química Industrial
[editar]Procesos de fabricación
La síntesis a escala industrial1 de la acetona se realiza mayoritariamente (90% de la capacidad en los EEUU) según el proceso catalítico de hidrólisis en medio ácido del hidroperóxido de cumeno, que permite también la obtención de fenol como coproducto, en una relación en peso de 0,61:1
Un segundo método de obtención (6% de la capacidad de los EEUU en 1995) es la deshidrogenación catalítica del alcohol isopropílico.
Otras vías de síntesis de acetona:
- Biofermentación
- Oxidación de polipropileno
- Oxidación de diisopropilbenceno
[editar]Producción
[editar]EE.UU.
En los EE.UU, el 90% de la producción de acetona manufacturada se realiza mediante el proceso de peroxidación de cumeno con una capacidad que alcanzó en el 2002 los 1,839 millones de toneladas. En el 2002 la capacidad se repartía en 11 plantas de fabricación pertenecientes a 8 compañías:2
Miles de toneladas:
- Sunoco (Frankford, Haverhill) 576
- Shell (Deer Park-Texas) 324
- Ineos Phenol (Theodore-Alabama) 274
- Dow (Freeport, Institute) 256
- MVPPP (Mount Vernon) 195
- Georgia Gulf (Pasadena, Plaquemine) 181
- JLM Chemicals (Blue Island) 25
- Goodyear Tire & Rubber (Bayport) 8
Total 1,839 millones de toneladas
[editar]España
Según el directorio3 de la Federación empresarial de la industria química española (FEIQUE) 5 compañías se dedican en España a la fabricación industrial de acetona:
- Cepsa Química (La Rábida,Palos de la Frontera, HUELVA)
- Química Farmacéutica Bayer, S.A.
- Rhodia Iberia S.A.
- Cor Química S.L. (Valdemoro, Madrid)
- PROQUIBASA (Barcelona)
- Quality Chemicals S.L. (Esparraguera, Barcelona)
[editar]Aplicaciones industriales y demanda
La repartición de las aplicaciones del uso de acetona en los EE.UU. se encontraba en el 2002 en los siguientes segmentos:2
- Cianohidrina acetona para Metil metacrilato (MMA) 42%
- Bisfenol A 24%
- Disolventes 17%
- Derivados del Aldol (MIBK y MIBC) 13%
- Varios 4%
La aplicación más importante de la acetona se encuentra en la fabricación de Metil metacrilato (MMA), mercado que experimenta una demanda creciente (3% anual) desde el 2002 por el incremento en los usos del Polimetilmetacrilato (PMMA), un material antifragmentación alternativo al vidrio en la industria de la construcción.
La demanda de Bisfenol-A y de resinas de policarbonato se ha duplicado en la década de los 1990, convirtiéndose en la segunda aplicación importante de la acetona (7% incremento anual), demandada por la industria del automóvil y de microelectrónica (fabricación de discos CD y DVD).
La demanda de acetona es un indicador del crecimiento económico de cada región ya que depende directamente de la marcha de las industrias del automóvil, construcción y microelectrónica. Así entre el 2000-2001 la demanda decreció un 9% mientras que en el 2002 apuntó una recuperación como resultado del resurgimiento económico estadounidense.
En los EE.UU. la demanda interna en el 2002 fue de 1,188 millones de toneladas, con un crecimiento medio en el periodo 1997-2002 del 0,9%. En el 2006 la demanda prevista era de 1,313 millones de toneladas.
[editar]Estado en el medioambiente
Se encuentra en forma natural en plantas, árboles y en las emisiones de gases volcánicos o de incendios forestales, y como producto de degradación de las grasas corporales. También se encuentra presente en los gases de tubos de escape de automóviles, en humo de tabaco y en vertederos. Los procesos industriales aportan una mayor cantidad de acetona al medio ambiente que los procesos naturales.
[editar]Metabolismo
La acetona se forma en la sangre cuando el organismo utiliza grasa en vez de glucosa como fuente de energía. Si se forma acetona, esto usualmente indica que las células carecen de suficiente insulina o que no pueden utilizar la presente en la sangre para convertir glucosa en energía. La acetona sigue su curso corporal hasta llegar a la orina. El aliento de personas que tienen gran cantidad de acetona en el organismo exhala olor a fruta y a veces se le denomina "aliento de acetona".
[editar]Riesgos para la salud
Si una persona se expone a la acetona, ésta pasa a la sangre y es transportada a todos los órganos en el cuerpo. Si la cantidad es pequeña, el hígado la degrada a compuestos que no son perjudiciales que se usan para producir energía para las funciones del organismo. Sin embargo, respirar niveles moderados o altos de acetona por períodos breves puede causar irritación de la nariz, la garganta, los pulmones y los ojos; dolores de cabeza; mareo; confusión; aceleración del pulso; efectos en la sangre; náusea; vómitos; pérdida del conocimiento y posiblemente coma. Además, puede causar acortamiento del ciclo menstrual en mujeres.
Tragar niveles muy altos de acetona puede producir pérdida del conocimiento y daño a la mucosa bucal. Contacto con la piel puede causar irritación y daño a la piel.
El aroma de la acetona y la irritación respiratoria o la sensación en los ojos que ocurren al estar expuesto a niveles moderados de acetona son excelentes señales de advertencia que pueden ayudarlo a evitar respirar niveles perjudiciales de acetona.
Los efectos de exposiciones prolongadas sobre la salud se conocen principalmente debido a estudios en animales. Las exposiciones prolongadas en animales produjeron daño del riñón, el hígado y el sistema nervioso, aumento en la tasa de defectos de nacimiento, y reducción de la capacidad de animales machos para reproducirse. No se sabe si estos mismos efectos pueden ocurrir en seres humanos.
Según el INSHT (documento se recogen los Límites de Exposición Profesional para Agentes Químicos adoptados por el Instituto Nacional de Seguridad e Higiene en el Trabajo (INSHT) para el año 2009), la acetona tiene un Valor Límite Admitido de 500 ppm ó de 1210 mg/m3
Fuentes:
Acetileno
Obtención del acetileno
En petroquímica se obtiene el acetileno por quenching (el enfriamiento rápido) de una llama de gas natural o de fracciones volátiles del petróleo con aceites de elevado punto de ebullición. El gas es utilizado directamente en planta como producto de partida en síntesis; un proceso alternativo de síntesis, más apto para el laboratorio, es la reacción de agua con carburo cálcico (CaC2). Se forma hidróxido de calcio y acetileno. El gas formado en esta reacción a menudo tiene un olor característico a ajo debido a trazas de fosfina que se forman del fosfuro cálcico presente como impureza.
[editar]Características
El acetileno es un compuesto exotérmico. Esto significa que la descomposición en sus elementos libera calor. Por esto su generación suele necesitar elevadas temperaturas en alguna de sus etapas o el aporte de energía química de alguna otra manera.
El acetileno es un gas explosivo si su contenido en aire está comprendido entre 2 y 82%. también explota si se comprime solo, sin disolver en otra sustancia, por lo que para almacenar se disuelve en acetona, un disolvente liquido que lo estabiliza.
[editar]Usos del acetileno
[editar]Primeros usos (s. XX)
A principios del siglo XX, el acetileno tenía múltiples aplicaciones debido a la fijeza y claridad de su luz, su potencia calorífica su facilidad de obtención y su bajo costo. Los aparatos generadores se habían también perfeccionado siendo casi todos ellos del sistema en que el agua cae sobre el carburo estando la caída de aquélla graduada de tal modo por diversos juegos deválvulas, palancas y contrapesos que casi se llegó a evitar la sobreproducción de gas que tanto dañaba a los aparatos anteriores.
El acetileno se utilizaba en generadores, en lámparas de minería o en el soplete oxiacetilénico empleado en la soldadura autógena produciendo temperaturas de hasta 3.000º, el alumbrado de proyectores para la marina y para cinematógrafos. Los automóviles llevaban también a principios del siglo en su mayoría faros con aparatos autogeneradores de acetileno. Se llegaron a construir diversos aparatos de salvamento como cinturones, chalecos, boyas, etc., en cuyo interior y en un depósito ad hoc llevaban una dosis de carburo de calcio dispuesto de tal suerte que al ponerse el carburo en contacto con el agua se produjera el gas acetileno dejando henchido convenientemente el aparato.1
[editar]En la actualidad
El acetileno se utilizaba como fuente de iluminación y de calor. En la vida diaria el acetileno es conocido como gas utilizado en equipos de soldadura debido a las elevadas temperaturas (hasta 3.000 °C) que alcanzan las mezclas de acetileno y oxígeno en su combustión.
El acetileno es además un producto de partida importante en la industria química. Hasta la segunda guerra mundial una buena parte de los procesos de síntesis se basaron en el acetileno. Hoy en día pierde cada vez más en importancia debido a los elevados costes energéticos de su generación.
Disolventes como el tricloretileno, el tetracloretano, productos de base como viniléteres y vinilésteres y algunos carbociclos (síntesis según Reppe) se obtienen a partir del acetileno. Éste también se utiliza en especial en la fabricación del cloroetileno (cloruro de vinilo) para plásticos, del etanal (acetaldehido) y de los neoprenos del caucho sintético.
Fuente:
Suscribirse a:
Entradas (Atom)